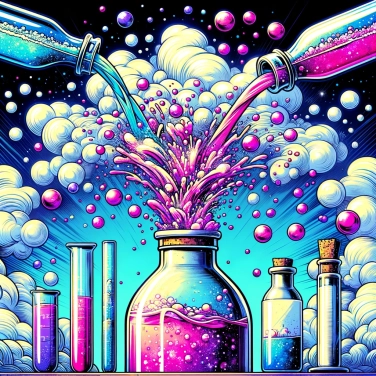
En détaillé, pour les intéressés !
Composition chimique du vinaigre et du bicarbonate de soude
Le vinaigre, c'est essentiellement de l'acide acétique dilué dans beaucoup d'eau. L'acide acétique est un composé organique simple qui donne au vinaigre son goût acide et piquant. Le bicarbonate de soude, lui, se compose principalement de bicarbonate de sodium, une poudre blanche plutôt fine composée d'un ion bicarbonate associé à un ion sodium. Son côté basique (ou alcalin) permet justement de neutraliser les acides. Ces deux substances, banalement présentes dans ta cuisine, attendent juste le bon moment pour entrer en réaction.
Interaction entre l'acide acétique et le bicarbonate de sodium
Quand le bicarbonate de soude (bicarbonate de sodium) entre en contact avec du vinaigre (qui contient de l'acide acétique), ils échangent leurs composants dans une petite danse chimique rapide. Concrètement, l'acide acétique attaque le bicarbonate, ce qui libère aussitôt du gaz carbonique (dioxyde de carbone). Cette formation de gaz provoque les fameuses bulles et la mousse qui déborde. En même temps, une réaction parallèle produit aussi de l'eau et un composé appelé acétate de sodium, qui reste dissout dans le mélange final. Cette réaction est dite acido-basique : l'acide du vinaigre réagit avec le bicarbonate (qui est une base), et ça pétille immédiatement !
Mécanisme de la réaction chimique observée
Quand on mélange le vinaigre et le bicarbonate, l'acide acétique du vinaigre réagit direct avec le bicarbonate de sodium. Le bicarbonate, sous l'effet de l'acide, relâche des ions qui réagissent très rapidement : il se forme alors du dioxyde de carbone gazeux, de l'eau liquide, et de l'acétate de sodium, qui reste dissous. Toutes ces transformations produisent des bulles visibles. Ce dégagement gazeux provoque l'effet moussant et pétillant qu'on connaît et adore, façon mini-volcan maison. Plus précisément, l'acidité du vinaigre pousse le bicarbonate à se décomposer pour libérer le gaz, d'où l'apparition rapide de mousse.
Les produits formés pendant la réaction
Le produit le plus visible est le dioxyde de carbone (CO₂). Ce gaz provoque les bulles et la mousse pétillante qu'on observe pendant la réaction. Le second produit principal, soluble dans l'eau obtenue lors du mélange, est l'acétate de sodium, une sorte de sel tout simple. Reste enfin tout simplement de l'eau, qui est produite au cours de la réaction chimique elle-même. Donc au final tu obtiens essentiellement un gaz (CO₂), un peu d'eau et un sel dissout dans la solution (acétate de sodium).
Facteurs influençant la vitesse et l'intensité de la réaction
La température est un facteur essentiel : plus elle est élevée, plus la réaction s'accélère et devient dynamique, comme si on donnait un coup d'accélérateur aux molécules en les chauffant un peu. La concentration des réactifs influence aussi beaucoup les choses : plus on rajoute de vinaigre ou de bicarbonate, plus c'est intense, rapide et spectaculaire, car davantage de molécules entrent en collision simultanément. Pareil, la finesse du bicarbonate (en poudre très fine par exemple) favorise grandement la rencontre rapide entre chaque petite particule et les molécules d'acide acétique dans le vinaigre, rendant la réaction plus instantanée. Enfin, l'agitation du mélange joue aussi : en mélangeant activement, on renouvelle vite le contact entre les réactifs, générant une réaction plus rapide.
![Explique pourquoi certains dieux hindous ont plusieurs bras ?]()
![Explique pourquoi la pression atmosphérique varie avec l'altitude ?]()
![Explique pourquoi le devoir de mémoire est important ?]()
![Explique pourquoi Anne Frank est-elle devenue un symbole de la résistance face à l'oppression pendant la seconde guerre mondiale ?]()